Untersuchung der Interaktion von ionischen Flüssigkeiten mit Zellhüllen, Proteinen und Nukleinsäuren von Pilz- und Bakterienzellen
In den letzten Jahren stützt sich die molekulare Diagnostik gesundheitsrelevanter Mikroorganismen zunehmend auf den Nachweis und die Quantifizierung ihrer Nukleinsäuren (NAs), DNA und RNA. Die Extraktion von NAs aus klinischen oder Umweltproben ist ein notwendiger Vorbereitungsschritt, um NA-basierte Tests zu ermöglichen.
Die DNA/RNA-Extraktion ist für viele Zielorganismen ein komplexer und mühsamer Prozess, der zusätzlich noch an verschiedene Probentypen angepasst werden muss. Die Extraktion dauert oft mehrere Stunden und erfordert teure Geräte oder gefährliche Chemikalien und gilt daher als ein großer Engpass für molekulardiagnostische Arbeitsabläufe. In den letzten Jahren haben sich ionische Flüssigkeiten (ILs), Salze mit einer Schmelztemperatur unter 100°C, als umweltfreundliche Lösungsmittel durchgesetzt.
ILs können Biomasse (Cellulose, Lignin, Chitin) effizient auflösen und wurden erfolgreich für die Extraktion von Pflanzenwirkstoffen, Proteinen und Zellen eingesetzt. Außerdem wurde festgestellt, dass sie DNA und kleine RNAs stabilisieren und Proteine denaturieren und rekonstituieren können.
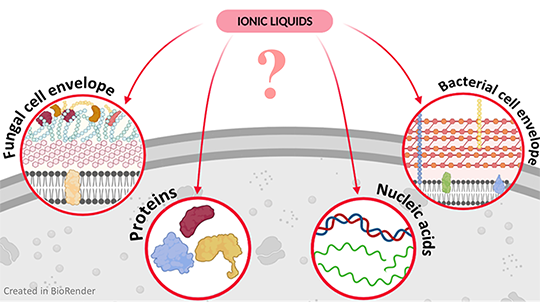
Kürzlich hat unsere Gruppe gezeigt, dass hydrophile ILs pflanzliche, tierische und bakterielle Zellen schnell und effektiv lysieren können, wodurch das Potenzial von ILs für die Extraktion von NAs in der Molekulardiagnostik demonstriert werden konnte. Die Mechanismen der Interaktion von ILs mit der mikrobiellen Zellwand, die zur Zelllyse führen, und die Auswirkungen von ILs auf Zelllysatkomponenten wie DNA, RNA und Proteine sind jedoch noch nicht ausreichend geklärt. Für Pilzzellen wurde eine IL-basierte Zelllyse bisher noch nicht einmal versucht.
In diesem Projekt wollen wir hydrophile ILs finden, die in der Lage sind, Pilz- und Bakterienzellen zu lysieren, und versuchen, die Art und Weise ihrer Wechselwirkung aufzuklären. Zunächst wollen wir die Interaktion der hydrophilen ILs mit den Komponenten der mikrobiellen Zellwand, die zur Zelllyse führt, untersuchen. Außerdem soll aufgeklärt werden, wie ILs DNA und RNA stabilisieren und mit Proteinen interagieren, die für die molekulare Diagnostik relevant sind (Nukleasen, Polymerasen). Dieses Verständnis der Wechselwirkung von hydrophilen ILs mit Zellwandkomponenten könnte künftig ein maßgeschneidertes Design von ILs für die schnelle und quantitative Extraktion von NAs aus einem breiten Spektrum von Zielorganismen ermöglichen.
Darüber hinaus ist ein Verständnis der Wechselwirkung von ILs mit NAs, Nukleasen und Polymerasen und deren Einfluss auf nachfolgende Reaktionen wie Hybridisierung, PCR oder Sequenzierung, für die Auswahl von ILs, die in molekulardiagnostischen Arbeitsabläufen verwendet werden sollen, von wesentlicher Bedeutung.
